Egy akut fájdalmat célzó analgetikumtól a betegek azt várják el, hogy gyors és hatékony legyen. Annak érdekében, hogy ez elérhető legyen és hogy a bizonyítottan hatékony ibuprofén hatóanyaggal tovább lehessen javítani az analgetikumokat, lényegében két megközelítés lehetséges: más hatóanyagokkal, mint pl. az adjuváns analgetikumként szolgáló koffeinnel való kombinálása vagy az ibuprofén lizinsó formájában való alkalmazása, melynek célja a véráramba való abszorpciójának gyorsítása (ami gyorsabb fájdalomcsillapítást eredményez).
 Magyarország
MagyarországAz ibuprofén farmakokinetikája: az ibuprofén és koffein fix kombinációjának összehasonlítása ibuprofén-lizináttal és ibuprofénsavval
Két – egyszeri adaggal végzett – vizsgálat eredményei (randomizált, egyközpontú, keresztezett, nyílt jelölésű)
Az ibuprofén (400 mg) és koffein (100 mg) együttes adásának fölényes hatásosságát az ibuprofén (400 mg) önmagában való alkalmazásával szemben egyértelműen megállapították [1]. Ugyanakkor két klinikai vizsgálatban tanulmányozták az ibuprofén kombinációjának és az ibuprofén-lizinátnak a farmakokinetikáját, mind éhgyomorra (több mint 10 órával az utolsó étkezés után), mind pedig egy átlagos reggeli elfogyasztása után [2].
Módszerek
Két klinikai vizsgálatot végeztek, mindkettőben 36 alany vett részt. Az első vizsgálatban (NCT01879371) az ibuprofén/koffein fix dózisú kombinációs készítményből származó ibuprofén farmakokinetikáját hasonlították össze két komparátor készítményben lévő ibuprofénével (sav vagy lizinát formájában). A vizsgálati készítmények bevételére több mint 10 órával az utolsó étkezés után került sor, ez idő alatt csak vizet volt szabad inni.
A második vizsgálatban (NCT02629354) a fix dózisú kombinációs készítményből származó ibuprofén farmakokinetikáját hasonlították össze az ibuprofénével (lizinát formájában) egy átlagos reggeli elfogyasztása után.
Ezek az egyszeri adaggal végzett vizsgálatok randomizáltak, egyközpontúak, keresztezettek és nyílt jelölésűek voltak. A mért kulcsparaméterek a maximális plazmakoncentráció (Cmax), az annak eléréséhez szükséges idő (tmax) és a teljes expozíció (AUC0–t) voltak. A koffeinre vonatkozóan is megmérték ezeket a paramétereket. Az analitikai és statisztikai módszerek megfeleltek a szokásos standardoknak [2].
Eredmények
Az éhgyomorra való bevétel a várt eredményeket mutatta: az ibuprofén-lizinát gyorsabban szívódott fel, mint az ibuprofénsav (a fix dózisú kombinációból vagy a csak ibuprofént tartalmazó készítményből); és a hasonló expozíció ellenére a maximális plazmakoncentráció magasabb volt (lásd a táblázatot).
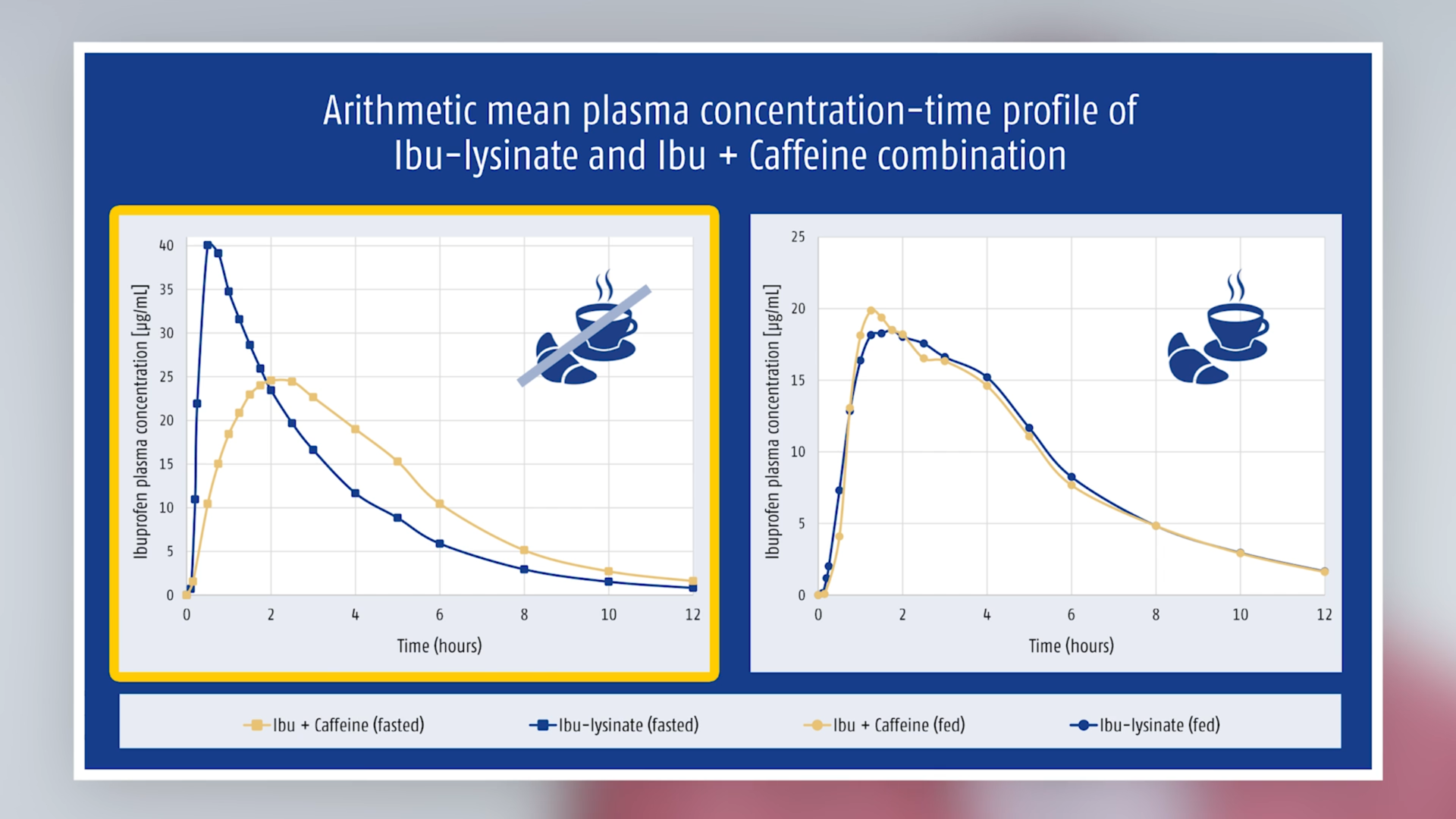
Más kép mutatkozott, amennyiben a bevételre egy átlagos reggeli után került sor, azaz nem éhgyomorra: ezen körülmények között a kombinációból származó ibuprofén plazmakoncentrációja magasabb volt, mint az ibuprofén-lizinátból származóé és a maximális plazmakoncentráció eléréséhez szükséges idő rövidebb volt (lásd a táblázatot és az 1. ábrát). Az éhgyomri és a nem éhgyomri állapotok közötti különbség szintén jelentősen kisebb volt, mint az ibuprofén-lizináttal (2. ábra).
1. ábra A fix dózisú kombinációból származó ibuprofén és koffein plazmakoncentráció – idő profiljának számtani középértékei
2. ábra Az ibuprofén (-lizinát) plazmakoncentráció-idő profiljának számtani középértékei
Megbeszélés és következtetések
Az európai gyógyszerengedélyeztető hatóságok meghatározása szerint az “éhgyomor” kifejezés azt jelenti, hogy a vizsgálati személy a vizsgálati készítmény bevétele előtt legalább 8 órán át, azt követően pedig 4 órán át nem eszik semmit, kizárólag szénsavmentes vizet iszik, és egy órával a bevétel előtt és után egyáltalán nem iszik semmit. A vizsgálati készítményeket pontosan 150 ml vízzel kell bevenni [3]. Ezek a standardizált feltételek lehetővé teszik a különböző vizsgálatok pontos összehasonlítását; ezek a feltételek azonban nagyon távol állnak a mindennapi élettől.
Az analgetikumokat rendszerint nem olyan körülmények között szedik, amelyek megfelelnek a gyógyszerszabályozó hatóságok “éhgyomorra” vonatkozó standard követelményeinek. Ezen állapot eléréséhez reggeli előtt kellene bevenni az analgetikumot (és csak akkor, ha a vacsora nem túl későn került elfogyasztásra!), és magát a reggelit is mellőzni kellene. Kizárólag ezek azok a körülmények, amelyek mellett bizonyított az ibuprofén-lizinát gyorsabb abszorpciója (és magasabb plazmakoncentrációja) az ibuprofénsavval szemben. Régebbi adatok igazolták, hogy egy átlagos reggeli után az ibuprofén-lizinát és az ibuprofénsav hasonló farmakokinetikai tulajdonságokkal rendelkezik, azaz az ibuprofén-lizinát nem előnyösebb [4]. Az újabb publikáció kimutatta, hogy nem éhgyomorra történő bevételt követően az ibuprofén-koffein kombinációs készítményből származó ibuprofén gyorsabban szívódik fel és magasabb plazmakoncentrációt ér el, mint az ibuprofén-lizinát [2].
Irodalom
- Weiser et al. Efficacy and safety of a fixed-dose combination of ibuprofen and caffeine in the management of moderate to severe dental pain after third molar extraction. Eur J Pain. 2018;22(1):28–38. doi: 10.1002/ejp.1068.
- Weiser et al. Pharmacokinetic Properties of Ibuprofen (IBU) From the Fixed-Dose Combination IBU/Caffeine (400/100 mg; FDC) in Comparison With 400 mg IBU as Acid or Lysinate Under Fasted and Fed Conditions-Data From 2 Single-Center, Single-Dose, Randomized Crossover Studies in Healthy Volunteers. Clin Pharmacol Drug Dev. 2019;8(6):742–753. doi: 10.1002/cpdd.672.
- EMA GUIDELINE ON THE INVESTIGATION OF BIOEQUIVALENCE, 2010 https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-investigation-bioequivalence-rev1_en.pdf (accessed 05.12.2019)
- Klüglich et al. Ibuprofen extrudate, a novel, rapidly dissolving ibuprofen formulation: relative bioavailability compared to ibuprofen lysinate and regular ibuprofen, and food effect on all formulations. J Clin Pharmacol. 2015;45(9):1055–61.
Érdekütközés: T. Weiser a Sanofi alkalmazottja.
Publikációk: Az alábbiak által anyagilag támogatott publikáció Sanofi Aventis Deutschland GmbH.